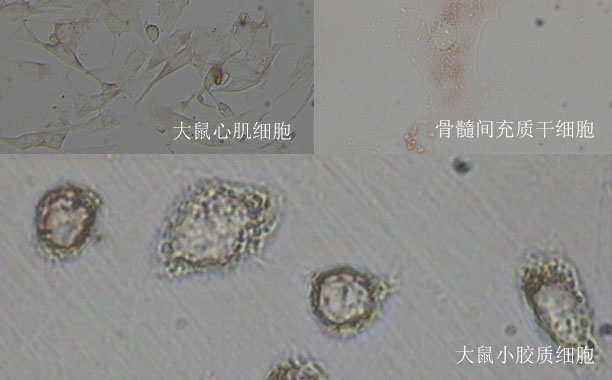
贵阳生物实验室:探讨构建出一种能够与小分子靶标结合的蛋白
蛋白由一长串的氨基酸组成。一旦合成结束后,这种氨基酸链折叠成精确的形状,从而使得蛋白能够发挥它的功能。这种氨基酸链所呈现出的形状通常是非常复杂的,但是两种常规的结构特征通常会出现:α-螺旋(alpha-helix),它是当这种氨基酸链中的片段绕着中心轴缠绕时形成的;被称作β折叠(beta-sheet)的片状结构。
当来自一种氨基酸链的不同部分的两个或以上的片段由于折叠而在三维空间中并排延伸时,β-折叠就形成了。这些片段通过氢键“缝合在一起”,从而形成这种片状结构。接着,这些β折叠能够组装成桶状结构:β桶。在自然界中,β-桶蛋白能够结合很多小分子。
为了设计出这些新的小分子结合蛋白,Dou和Vorobieva使用了一种在Baker实验室开发的软件平台Rosetta。它能够预测一种特定的氨基酸链在合成后将呈现出何种形状,并且能够判断这种氨基酸链中的单个氨基酸的变化如何改变这种形状。这种预测能力使得测试利用不同的氨基酸组合来设计出具有所需形状和功能的蛋白成为可能。
为了让β桶蛋白的一端形成一种用于结合小分子靶标的腔室,这些研究人员使用了一种强大的新的对接算法,它被称为“旋转异构体相互作用场(RIF),是由Baker实验室的高级研究员William Sheffler开发出来的。RIF可快速地鉴定出满足结合特定分子的先决条件的所有潜在的腔室结构。
在这项新的研究中,Dou、Vorobieva和Sheffler利用这种的RIF对接算法设计出能够结合一种被称作DFHBI的化合物的β桶蛋白。DFHBI 是一种类似于绿色荧光蛋白 (GFP) 发色团的小分子,当暴露在某些频率的光线下时会发出荧光。
研究证实定制设计的β桶蛋白能够强烈地结合并激活DFHBI化合物。他们设计出的这些β桶蛋白能够在细菌细胞、酵母细胞和哺乳动物细胞中发挥作用,而且鉴于它们的大小仅为绿色荧光蛋白的一半,它们应当对科学家们是非常有用的。
相关标签:
实验
本文链接: http://jcswbio.com/news/8638.html
本文链接: http://jcswbio.com/news/8638.html
![贵州吉创生物技术有限公司[官网]](/Public/Uploads/image/picture/160userid20180911_p1536645747.png)