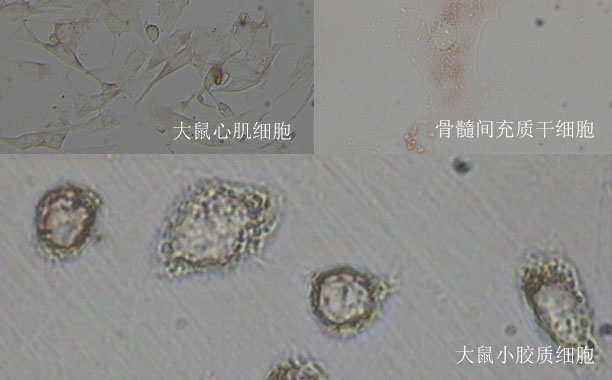
尾锚定蛋白是一类跨膜区在C端的膜蛋白,定位于特定的细胞器膜上。它们的定位信号包括C端跨膜区及其旁侧序列,被各种分拣机器识别。例如Pex19和GET通路分别分拣定位于过氧化物酶体和内质网的尾锚定蛋白。当分拣机器GET3缺失时,部分尾锚定蛋白会错误定位到线粒体外膜,并被线粒体AAA-ATPase Msp1特异识别并清除。线粒体外膜本身具有多个尾锚定蛋白,Msp1识别底物,区分错误和正确定位的尾锚定蛋白的分子机理尚不清楚。

等生化手段分析了Msp1和多个底物的互作及降解,发现错误定位的尾锚定蛋白因失去正确互作蛋白等原因,会在细胞质暴露疏水区域。这些疏水区域会被Msp1 N端高度保守的疏水氨基酸识别。将Msp1底物疏水区域移植到线粒体自身尾锚定蛋白上可以导致它们被Msp1识别和降解。
同时,多个错误定位的尾锚定蛋白在跨膜区膜间隙一侧含有多个带正电的氨基酸。这些序列模拟了线粒体自身尾锚定蛋白的定位序列特征,导致错误定位的发生。相应地,Msp1通过膜间隙一个高度保守的带负电的天冬氨酸识别这这些正电荷,增强蛋白互作。这种在细胞质和线粒体膜间隙进行双重识别的分子机制帮助Msp1高效识别底物,从而维护线粒体蛋白质组稳定性和保护线粒体功能。
![贵州吉创生物技术有限公司[官网]](/Public/Uploads/image/picture/160userid20180911_p1536645747.png)